正海Family | 正海资本被投企业-鹍远生物推出肝癌多基因甲基化检测技术,助力我国肝癌筛查
前言
原发性肝癌(Primary Liver Cancer,PLC)是全球常见的恶性肿瘤之一,由于肝癌起病隐匿,绝大多数患者在确诊时就已经处于中晚期。肝癌多基因甲基化检测技术是德同资本被投企业鹍远生物通过自主研发的MONOD®基因组筛选方法和mTitan®靶向甲基化测序技术,可精准识别早癌,对肝癌的发生风险予以示警。当前,我国已有多部指南/共识将基因甲基化推荐用于肝癌早期筛查和诊断。
肝癌严重威胁我国居民的生命健康
原发性肝癌(Primary Liver Cancer,PLC)是全球常见的恶性肿瘤之一。根据2020年世界卫生组织国际癌症研究机构(IACR)发布的2020年全球最新癌症负担数据,全世界每年新发肝癌91万例,因肝癌死亡83万例,肝癌已经成为全球发病率第6,死亡率第3的癌症[1]。我国是肝癌大国,全世界一半左右的肝癌发生在中国。据国家癌症中心发布的最新全国癌症统计数据显示,中国2016年原发性肝癌发病人数居恶性肿瘤第4位(38.9万),死亡人数居第2位(33.6万)[2],每年的肝癌发病率和病死率非常接近。
由于肝癌起病隐匿,绝大多数患者在确诊时就已经处于中晚期,肝癌的五年总生存率目前仅为14.1%[3],如果得不到有效的治疗,多数自然生存期不超过半年。如果能够尽早发现,患者将可以得到更有效的手术治疗,据统计早期肝癌的5年生存率可高达90%[3,4]。
高危人群众多,肝癌防控任重道远
肝癌的流行特点与其致病因素的分布特征密切相关。由国家卫生健康委办公厅发布的《原发性肝癌诊疗指南》(2022年版)[5]指出,在我国,肝癌高危人群主要包括:具有乙型肝炎病毒(HBV)和/或丙型肝炎病毒(HCV)感染、过度饮酒、非酒精性脂肪性肝炎、其他原因引起的肝硬化以及有肝癌家族史等人群,尤其是年龄>40岁的男性。
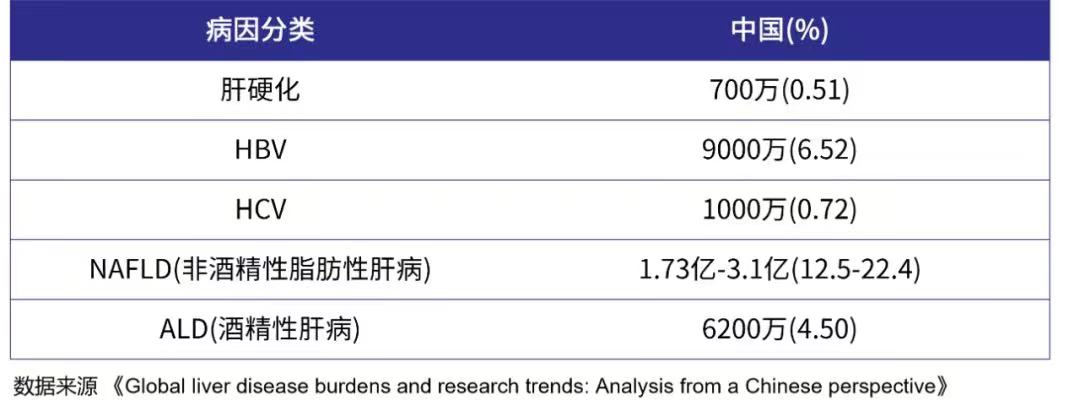
根据《Journal Of Hepatology》数据显示,目前,我国肝硬化患者(700万)和肝炎患者(HBV携带者9000万,HCV携带1000 万)合计约1.07亿人,而NAFLD和ALD人群规模也非常庞大,国家医疗负担相当严重。
表1. 我国肝病流行病学数据
传统方法的检测性能和可及性制约了临床筛查的有效实施
目前肝癌筛查方式主要包括血液学AFP(甲胎蛋白)检测和影像学检查。从目前诊疗路径来看[3,5],肝癌早筛通常联合AFP和肝脏超声(US)对肝癌高危人群进行定期筛查,发现异常再进一步考虑CT或者核磁共振检查。
甲胎蛋白(AFP)是目前诊断肝癌应用最多的血清学标志物,但仍有近40%肝癌患者AFP持续在正常或较低水平,而且妊娠、活动性肝炎、生殖系统肿瘤、胃肠胰腺等其他消化道肿瘤等人群血清AFP也会升高[6]。
虽然超声(US)设备简单,价格低容易开展,在临床上广泛应用,但其对早期肝癌诊断灵敏度仅47%[7],且受肝硬化结节干扰,对操作者经验要求较高。即使联合应用AFP和超声检测,对早期肝癌的灵敏度也仅有63%[7],仍然无法满足早期肝癌筛查的需求。
CT平扫对于极早期肝癌(<1 cm)或密度近似正常肝实质的肝癌难以显示,且具有一定的放射性[8-10]。
MRI虽然性能较超声(US)和CT较大提升,但检测的灵敏度和特异性也存在一定的天花板[10]。我国人口基数大、经济水平不足,将其作为常规筛查手段也不大现实。
基因甲基化已被写入权威指南/共识
当前,我国已有多部指南/共识将基因甲基化推荐用于肝癌早期筛查和诊断。其中,国家癌症中心赫捷院士和陈万青教授最新发表的《中国人群肝癌筛查指南(2022,北京)》[11]认为,体循环中新型标志物的液体活检手段与血清AFP比较也体现出更高的灵敏度和特异度,包括微小核糖核酸和循环肿瘤DNA等。这些证明有良好筛查价值的血清或ctDNA可作为补充筛查技术,但尚不能完全替代血清AFP检测。2021年由王红阳院士牵头撰写的《中国肝癌早筛策略专家共识》[3]明确指出cfDNA表观遗传性修饰检测有一定的应用潜力,可以作为个体化诊断的补充。同年,由中华医学会肝病学分会发布的《原发性肝癌二级预防共识》[12]中提到,有多种处于探索阶段的新型血清学分子标志物,其中包括循环肿瘤DNA甲基化等,在诊断肝细胞癌上有其特定的优势。
肝癌多基因甲基化检测技术助力肝癌早诊早治
肝癌多基因甲基化检测技术是鹍远生物通过自主研发的MONOD®基因组筛选方法和mTitan®靶向甲基化测序技术,通过数千例样本甄选出最优的肝癌特异性甲基化区域。然后,基于mGuard®技术,高效捕捉和放大血液中微量的肝癌相关基因甲基化信号,精准识别早癌,对肝癌的发生风险予以示警。

参考文献
[1] Latest global cancer data: Cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020. Retrieved Dec 16, 2020, from https://www.iarc.fr/fr/news-events/latest-global-cancer-data-cancer-burden-rises-to-19-3-million-new-cases-and-10-0-million-cancer-deaths-in-2020/
[2] Zheng R , Zhang S , Zeng H , et al. Cancer incidence and mortality in China, 2016[J]. Journal of the National Cancer Center, 2022.2(1):1-9.
[3]全国多中心前瞻性HCC极早期预警筛查项目(PreCar)专家组. 中国HCC早筛策略专家共识[J]. 肝脏, 2021, 26(8):7.
[4] ESMO Guidelines Working Group. Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012;23 Suppl 7:vii41-8.
[5] 中华人民共和国国家卫生健康委员会. 原发性HCC诊疗指南(2022年版)[J]. 中华普通外科学文献:电子版, 2022, 16(2):16.
[6] AlSalloom AA. An update of biochemical markers of hepatocellular carcinoma. Int J Health Sci (Qassim). 2016 Jan;10(1):121-36.
[7] Tzartzeva K, Obi J, Rich NE, et al. Surveillance Imaging and Alpha Fetoprotein for Early Detection of Hepatocellular Carcinoma in Patients With Cirrhosis: A Meta-analysis. Gastroenterology. 2018 May;154(6):1706-1718.e1.
[8] 中华医学会肝病学分会. 原发性HCC二级预防共识(2021年版)[J]. 中华肝脏病杂志, 2021, 29(3):11.
[9] 夏锋, 张大志. 肝细胞癌癌前病变的诊断和治疗多学科专家共识(2020版)[J]. 中华肝脏病杂志, 2020, 28(1):7.
[10] Jiang HY, Chen J, Xia CC, Cao LK, Duan T, Song B. Noninvasive imaging of hepatocellular carcinoma: From diagnosis to prognosis. World J Gastroenterol. 2018 Jun 14;24(22):2348-2362.
[11] 赫捷, 陈万青, 沈洪兵, 等. 中国人群肝癌筛查指南(2022,北京)[J]. 中华消化外科杂志, 2022, 21(8): 971-996.
[12] 中华医学会肝病学分会, 南月敏,徐小元. 原发性肝癌二级预防共识(2021年版)[J]. 临床肝胆病杂志, 2021, 37(3):11.


